Nikl a sloučeniny (jako Ni)
Nikl a sloučeniny (jako Ni)
- Základní informace
- Ohlašovací prahy pro úniky a přenosy pro ohlašování do IRZ/E-PRTR
- H- a P-věty
- Základní charakteristika
- Použití
- Zdroje úniků
- Dopady na životní prostředí
- Dopady na zdraví člověka, rizika
- Celkové zhodnocení nebezpečnosti z hlediska životního prostředí
- Způsoby zjišťování a měření
- Další informace, zajímavosti
- Informační zdroje
Základní informace
| Pořadové číslo látky v IRZ/E-PRTR | 22 |
| Další názvy | slitiny niklu – Monelův kov, Alnico, bílé zlato |
| Číslo CAS | 7440-02-0 |
| Chemický vzorec | Ni |
Ohlašovací prahy pro úniky a přenosy pro ohlašování do IRZ/E-PRTR
| Úniky do ovzduší (kg/rok) | 50 |
| Úniky do vody (kg/rok) | 20 |
| Úniky do půdy (kg/rok) | 20 |
| Přenosy v odpadních vodách (kg/rok) | 20 |
| Přenosy v odpadech (kg/rok) | - |
| Rizikové složky životního prostředí | ovzduší, voda, půda |
H- a P-věty
| Číslo CAS 7440-02-0; Indexové číslo 028-003-00-2* | |
| Standardní věty o nebezpečnosti | Pokyny pro bezpečné zacházení |
H317 Může vyvolat alergickou kožní reakci H351 Podezření na vyvolání rakoviny H372 Způsobuje poškození orgánů při prodloužené nebo opakované expozici H413 Může vyvolat dlouhodobé škodlivé účinky pro vodní organismy | P261 Veškeré kontaminované části oděvu okamžitě svlékněte. P272 Kontaminovaný pracovní oděv neodnášejte z pracoviště. P280 Používejte ochranné rukavice/ochranný oděv/ochranné brýle/obličejový štít. P302+P352 Při styku s kůží: Omyjte velkým množstvím vody/… P333+P313 Při podráždění kůže nebo vyrážce: Vyhledejte lékařskou pomoc/ošetření. P362+P364 Kontaminovaný oděv svlékněte a před opětovným použitím vyperte. P201 Před použitím si obstarejte speciální instrukce. P202 Nepoužívejte, dokud jste si nepřečetli všechny bezpečnostní pokyny a neporozuměli jim. P308+P313 Při expozici nebo podezření na ni: Vyhledejte lékařskou pomoc/ošetření. P260 Nevdechujte prach/dým/plyn/mlhu/páry/ aerosoly. P270 Při používání tohoto výrobku nejezte, nepijte ani nekuřte. P314 Necítíte-li se dobře, vyhledejte lékařskou pomoc/ošetření. P273 Zabraňte uvolnění do životního prostředí. |
* Indexové číslo, harmonizovaná klasifikace dle přílohy VI, nařízení (ES) č. 1272/2008, ve znění pozdějších předpisů.
Základní charakteristika
Nikl je bílý, feromagnetický, kujný a tažný kov. Je dobrým vodičem tepla a elektřiny. Nejběžnějším oxidačním stavem je +2. V komplexních sloučeninách se může vyskytovat i s oxidačním číslem 0, +1 a +3.
Použití
Asi 65 % niklu se spotřebovává na výrobu nerez oceli. Dalších 12 % se využívá na výrobu vysoce legovaných slitin. Zbývajících 23 % niklu se používá na výrobu slitin, nabíjecích baterií, katalyzátorů a dalších chemikálií, keramiky, mincí a odlitků, k barvení skla (na zeleno) a k pokovování.
Díky poměrně velmi dobré stálosti kovového niklu vůči atmosférickým vlivům i vodě se často nanáší velmi tenká niklová vrstva na povrchy méně odolných kovů, nejčastěji železa. Běžně se takto upravují jednoduché pracovní nástroje jako šroubováky nebo klíče, ale také některé chirurgické nástroje a pomůcky se niklují. Značné odolnosti kovového niklu se využívá při výrobě chemického nádobí, které je možno vystavit účinkům alkalických tavenin. Nikl patří společně se železem, chromem a manganem mezi základními kovy, které slouží pro legování ocelí. Jemně rozptýlený elementární nikl je velmi účinným hydrogenačním katalyzátorem. Využívá se v potravinářství k výrobě ztužených tuků z rostlinných olejů.
Nikl je součástí velmi odolných slitin jako např. Monelův kov o složení 68 % Ni a 32 % Cu se stopami manganu a železa, používaný pro výrobu lodních šroubů ale i kuchyňského vybavení. Slitiny Alnico se skládají z železa, kobaltu, niklu, hliníku a mědi a slouží pro výrobu velmi silných permanentních magnetů. Významné místo patří slitinám niklu ve výrobě šperků. V současné době poměrně populární bílé zlato je obvykle právě slitinou zlata, niklu, mědi a zinku. Zvláštní slitina niklu a stříbra slouží často jako materiál pro výrobu elektrických kontaktů v silně namáhaných silnoproudých spínačích, které musí vykazovat vysokou úroveň spolehlivosti. Jde o směs o složení přibližně 90 % stříbra + 10 % niklu. Výslednému materiálu potom stříbro dodává vynikající elektrickou vodivost a nikl zase výhodné mechanické vlastnosti - tvrdost a odolnost proti otěru.
Značná část celosvětově vyrobeného niklu končí v současné době jako surovina pro výrobu elektrických článků s možností mnohonásobného dobíjení. Nikl-hydridové baterie slouží jako zdroj elektrické energie v řadě mobilních telefonů, přenosných svítilen a dalších. Pro zdroje s vyšší elektrickou kapacitou se používají spíše nikl-kadmiové galvanické elektrické články. Vzhledem k prokázané toxicitě kadmia se však výroba těchto baterií postupně omezuje. V laboratoři se nikl používá jako katalytický kov, jeho slitina s hliníkem (Raneyův nikl) se používá jako redukční činidlo. Vzhledem k jeho toxicitě je jeho praktické využití postupně omezováno.
Zdroje úniků
Nejdůležitější niklové rudy jsou nikelin (niccolit) NiAs, breithauptit NiSb a pentlandit (Ni,Fe)9S8. Nejvyšší obsah niklu (78,58 % Ni) má ze všech nerostů bunsenit NiO. Celkem je známo téměř 200 nerostů s obsahem niklu. Pentlandit obsahuje obvykle vysoké příměsi ruthenia a je jeho nejdůležitějším zdrojem. K dalším známým minerálům s obsahem niklu patří např. millerit NiS, rammelsbergit NiAs2, niklskutterudit NiAs3, annabergit Ni3(AsO4)2·8H2O, bunsenit NiO, dienerit Ni3As, imgreit NiTe, melonit NiTe2 nebo sederholmit NiSe. Přirozeným zdrojem niklu v atmosféře jsou aerosoly z mořské hladiny, půdní prachy a sopečný popel. Nikl se také uvolňuje při lesních požárech. Část atmosférického niklu pochází z meteoritického prachu. Meteority obsahují 5 – 50 % niklu. Antropogenním zdrojem je těžba a zpracování niklu a spalování fosilních paliv a odpadů.
Nikl může vstupovat do vody přirozeně rozpouštěním minerálů dna nebo může být obsažen v dešťové vodě. Antropogenním zdrojem jsou především odpadní vody z povrchové úpravy kovů a dále odpadní vody z barevné metalurgie. Dalším zdrojem mohou být poniklované části zařízení přicházejících do styku s vodou. Zvýšení koncentrace niklu v půdě může být způsobeno aplikací čistírenských kalů. Významný podíl zaujímají spalovací procesy a rafinerie ropy a plynu.
Mezi nejvýznamnější antropogenní emise patří:
- spalování fosilních paliv a odpadů;
- rafinerie ropy a plynu;
- těžba a zpracování niklu;
- aplikace čistírenských kalů do půdy.
Dopady na životní prostředí
Nikl patří mezi významně toxické těžké kovy. Nikl přítomný v ovzduší se může atmosférickou depozicí dostávat do půdy nebo vody. Nikl se váže na částice obsahující železo a mangan, které se často vyskytují v půdě a sedimentech. Proto se zde vyskytuje většina niklu v prostředí. V přírodní vodě při pH 5 - 9 je dominantní formou výskytu Ni2+. V tomto rozmezí pH se nikl může sorbovat na oxidy železa a manganu nebo tvořit komplexní sloučeniny s anorganickými ligandy. Toxicita niklu pro některé vodní organismy je poměrně vysoká, proto je jeho přípustná koncentrace ve vodárenských tocích limitována přísněji než v pitné vodě. Rostliny přijímají nikl z půdy převážně kořeny, jsou schopné ho akumulovat. Snížením pH se zvyšuje mobilita niklu a tím i příjem rostlinami.
Dopady na zdraví člověka, rizika
Nikl patří mezi prvky, jejichž vliv na zdravotní stav lidského organismu je jednoznačně negativní. Je silně alergenní a patří mezi lidské karcinogeny (rakovina plic, nosní přepážky a vzácněji hltanu). Vyskytuje se ve stopách v organismu, např. v některých enzymech. Jeho biologická funkce však zatím není známa. Při kontaktu způsobuje vznik kožní dermatitidy, nazývané niklový svrab. 6 – 10 % obyvatelstva trpí alergií na nikl. Projevuje se zarudnutím kůže a později až vznikem kožních ekzémů při trvalém styku s předměty z niklu. Zvláště nebezpečné jsou náušnice, protože oblast ucha patří mezi velice senzitivní části lidského těla a alergické působení zde může nabývat dramatičtějších rozměrů – otoky hlavy, astmatické záchvaty. Akutní otrava má za následek poškození zažívacího traktu, cév, ledvin, srdce a centrální nervové soustavy. Dlouhodobá expozice vysokým dávkám niklu způsobuje snížení váhy, poškození srdce a jater a záněty kůže.
Nikl může být přijímán potravou (90 % celkového příjmu), inhalačně nebo pokožkou. Příjem potravou však nepředstavuje velké riziko, protože pouze 2-3 % niklu přijatého potravou je skutečně absorbováno. Ohroženou skupinou jsou kuřáci, protože v cigaretovém kouři se vyskytuje velmi toxický tetrakarbonyl niklu v koncentraci 1,1 až 3,1 µg. Tetrakarbonyl niklu je nejtoxičtější sloučenina niklu, je to těkavá kapalina působící především na dýchací systém. Otrava se po několikahodinové latentní periodě projevuje bolestmi hlavy, závratěmi, podrážděním, záněty horních cest dýchacích až edémem plic. Respirační systém je hlavním cílovým orgánem také při expozici prachu obsahujícímu nikl nebo jeho sloučeniny. Inhalace prachu s obsahem Ni způsobuje podráždění dýchacích cest, alergické astma. U dělníků pracujících s niklem ve slévárnách byla prokázána souvislost mezi expozicí (vylučováním niklu v moči) a poškozením ledvinových tubulů.
V České republice platí pro koncentrace niklu a jeho sloučenin následující limity v ovzduší pracovišť:
- Pro nikl: PEL – 0,5 mg.m-3, NPK - P – 1 mg.m-3;
- Pro tetrakarbonyl niklu: PEL – 0,01 mg.m-3, NPK - P – 0,02 mg.m-3;
- Pro sloučeniny niklu s výjimkou tetrakarbonylu niklu: PEL – 0,05 mg.m-3, NPK - P – 0,25 mg.m-3.
Celkové zhodnocení nebezpečnosti z hlediska životního prostředí
Nikl z toxikologického hlediska je zařazen mezi významné jedy (zvláště NiS, NiO a tetrakarbonyl niklu). Je silně alergenní a patří mezi lidské karcinogeny (rakovina plic, nosní přepážky a vzácněji hltanu). Nikl je nebezpečný pro vodní organismy. Proto je v povrchových vodách limitován přísněji než ve vodách pitných.
Způsoby zjišťování a měření
Pro stanovení niklu ve vodných roztocích lze obecně použít techniku atomové absorpční spektrometrie (AAS), nejlépe s hydridovou atomizací, dále techniku ICP-OES (emisní spektrometrie s indukčně vázaným plazmatem) nebo ICP-MS (hmotnostní spektrometrie s indukčně vázaným plazmatem). Pro stanovení Ni v matricích je k dispozici řada normovaných postupů:
| Norma | Metoda měření Ni | Oblast použití |
| EN 14385:2004* | Stanovení celkových emisí Ni, As, Cd, Cr, Co, Cu, Mn, Pb, Sb, TI a V | Kvalita ovzduší, emise ze stacionárních zdrojů |
| EN ISO 11885:2004 | Stanovení 33 prvků atomovou emisní spektrometrií s indukčně vázaným plazmatem (ICP AES) | Kvalita vod |
| EN 26595:1992 | Stanovení Ni spektrofotometrickou metodou s diethyldithiokarbamanem stříbrným (ISO 6595:1982) | Kvalita vod |
* Evropská norma EN 14385:2004 má status české technické normy.
Množství emitovaného niklu je možné odhadnout z rozdílu mezi koncentracemi niklu v surovině a v produktu. Pevné vzorky (půda, prašný aerosol) je nutné před vlastním stanovením mineralizovat kyselinou dusičnou. Služby poskytují komerční laboratoře.
Při koncentraci niklu 50 mg.l-1 v odpadní vodě odpovídá dosažení ohlašovacího prahu pro emise a přenosy do vody vypuštění 400 m3 odpadní vody ročně. Práh pro emise po ovzduší je dosažen při vypouštění 500 000 m3 odpadního vzduchu o koncentraci 100 mg.m-3 (pokud byl údaj o koncentraci uveden při stejné teplotě a tlaku jako objem plynu).
Další informace, zajímavosti
Nikl patří již dlouhou dobu mezi tzv. mincovní kovy, používané k ražení mincí, obvykle ve slitinách s mědí. V České republice jsou z těchto slitin vyráběny především mince o nominální hodnotě 1, 2 a 5 Kč. V Evropské unii se tento problém týká minci s nominální hodnotou 1 a 2 eura.
Obrázek 1 ukazuje vztahy mezi koncentrací niklu a možným ohrožením. Graf je k dispozici na webových stránkách agentury US EPA (USA).
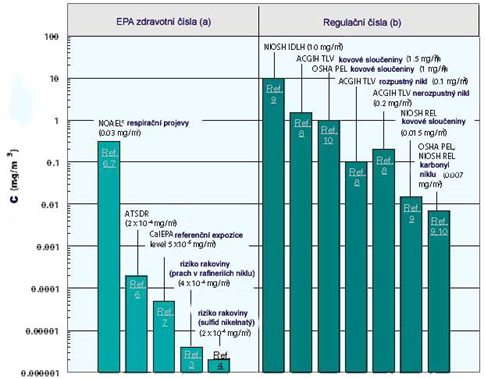
Obrázek 1: Vztahy mezi koncentrací niklu a možným zdravotním rizikem
Informační zdroje
- Encyklopedie Wikipedia, https://cs.wikipedia.org/wiki/Nikl, https://en.wikipedia.org/wiki/Nickel
- Agency for Toxic Substances and Disease Registry, https://www.atsdr.cdc.gov
- Hazardous Substance Fact Sheets, State of New Jersey Department of Health, http://www.state.nj.us/
- Environment Agency, https://www.gov.uk/government/organisations/environment-agency
- PubChem, Open Chemistry Database, https://pubchem.ncbi.nlm.nih.gov/compound/935
- Centers for Disease Control and Prevention, https://www.cdc.gov/niosh/topics/nickel/
- Databáze Eurochem, https://chemax.cz/#/record/eEFjNUtCdzUyVVE9
- Harte J., Holdren C., Schneider R., Shirley Ch.: Toxics A to Z, A Guide to Everyday Pollution Hazards, University of California Press, 1991
- Weiner E. R.: Applications of Environmental Chemistry, A Practical Guide for Environmental Professionals, Lewis Publishers, 2000
- Pitter P.: Hydrochemie, Vydavatelství VŠCHT, 1999
- Horáková M.: Analytika vody, VŠCHT Praha, 2003
- Paleček J., Linhart I., Horák J.: Toxikologie a bezpečnost práce v chemii, VŠCHT Praha 2008
- Periodická tabulka, http://www.prvky.com/28.html
- Igor Linhart: Toxikologie, VŠCHT Praha, 2014
- European Industrial Emissions Portal, https://industry.eea.europa.eu/pollutants/pollutant-index
- ČSN online, https://csnonline.agentura-cas.cz/